现代量子化学--O2分子的研究
1.对O2分子结构进行优化
对O2分子的单重态以及三重态进行优化。
输入文件(注意文件最后需要空两行)
PS:比较不同基组状态下能量的时候,需要注意D轨道类型,比如利用6-31g基组,默认使用笛卡尔型D轨道(6个D轨道),得到的能量肯定是比使用5个D轨道的能量更低的。因此比较不同基组的能量时,需要加上5D关键词。
这里比较的是同一基组下的单三重态能量,因此不必添加基组类型的关键词。
|
单重态: %chk=O2_singlet_opt.chk O2 singlet opt 0 1
|
三重态: %chk=O2_triplet_opt.chk O2 triplet opt 0 3
|
输入输出文件: 点击下载
2.对fchk文件中轨道进行可视化
具体操作步骤请移步结合Multiwfny以及vmd,一键生成一系列轨道
3.结果分析
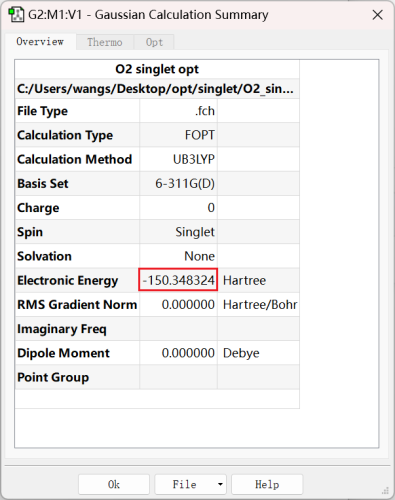
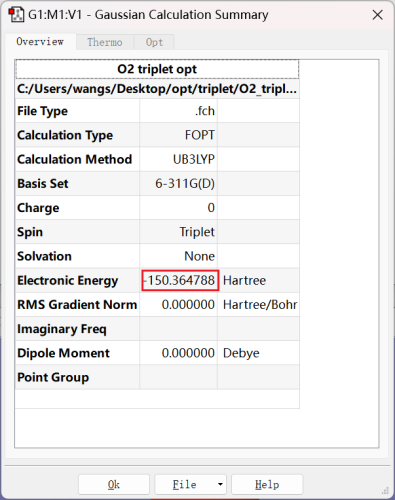
a)体系能量
|
单重态: |
三重态: |
很明显,三重态的能量更低,因此O2分子的基态为三重态。
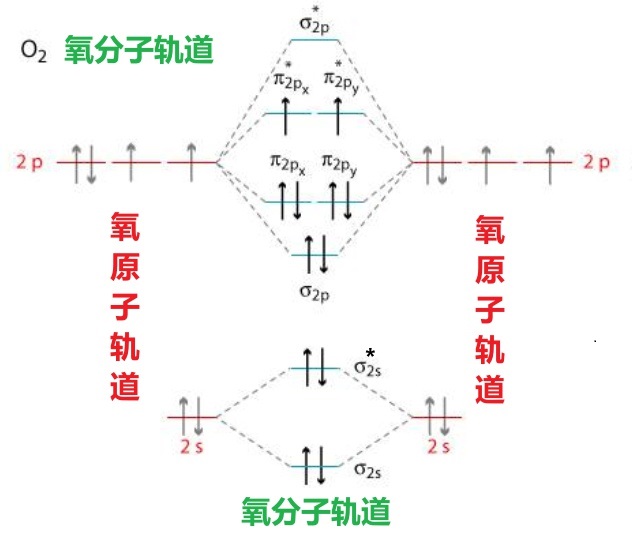
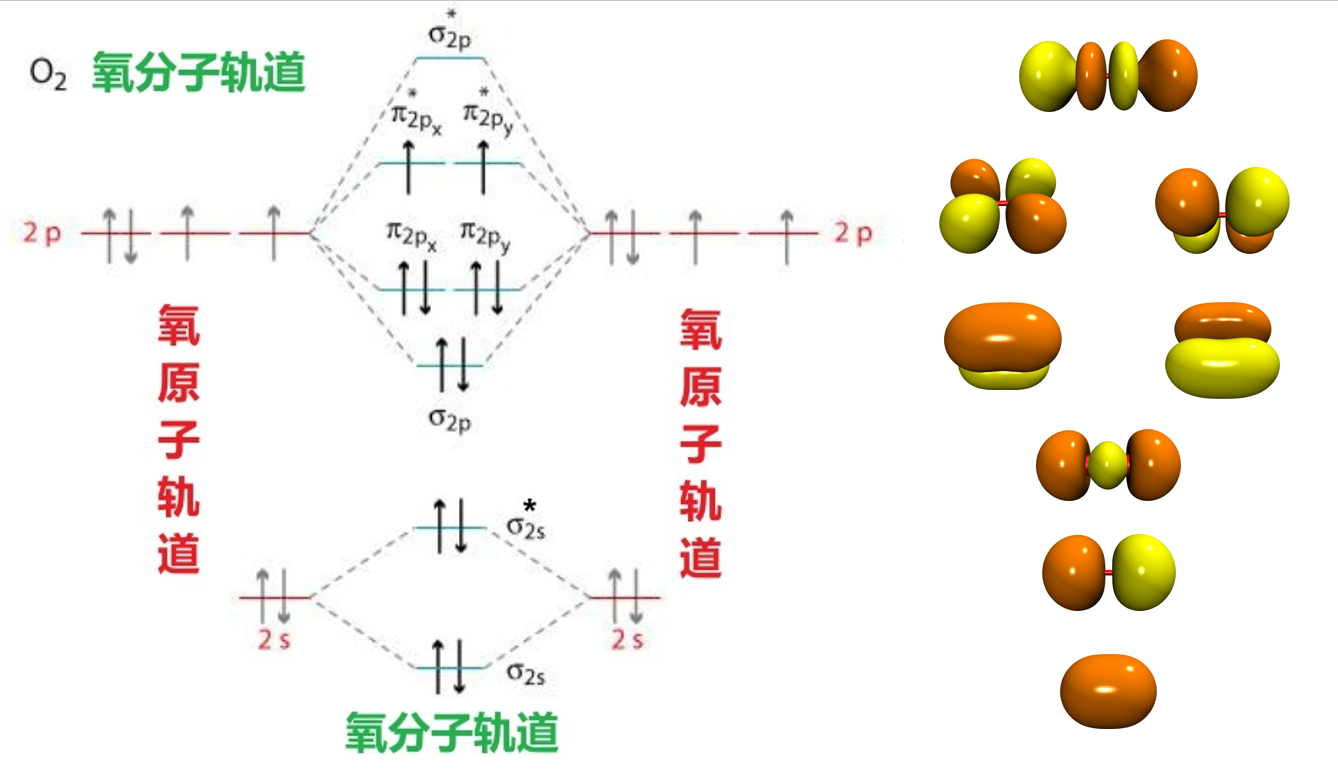
b)O2的分子轨道
O原子的层外电子排布为:1S2 2S2 2P4, 两个O原子的原子轨道组合成分子轨道如下图所示,由于O1s的轨道比较局域化,因此只画出来O2分子的价分子轨道。
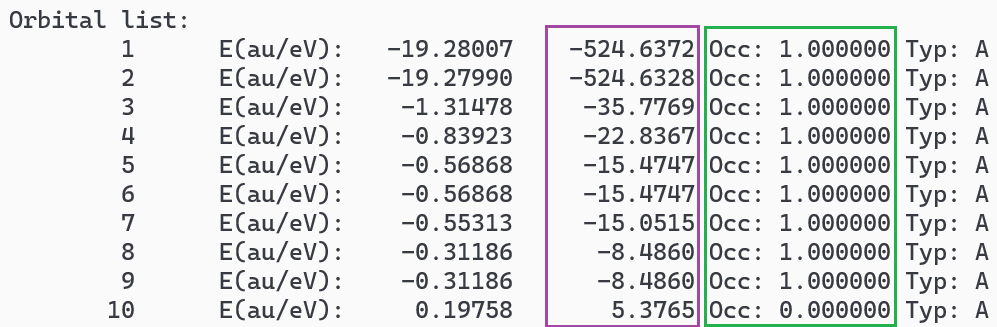
c)各个轨道的能量,轨道占据数目,轨道形状
|
α轨道的前10个轨道: |
β轨道的前10个轨道: |
这里的前两个轨道为两个O1s组合的分子轨道,从第三个轨道开始与前面的O2分子轨道图相对应。同时可以看到能量简并轨道的存在。